RESÚMENES
Inhibición del SGLT para el control de la diabetes tipo 1. ¿Hasta dónde hemos llegado?
Presentado por:Ele Ferrannini, MD, PhD
CNR (Consiglio Nazionale delle Ricerche), Institute of Clinical Physiology, Pisa, Italy
Paresh Dandona, MD
State University of New York at Buffalo, Buffalo, NY; USA
Juilo Rosenstock, MD
University of Texas Southwestern Medical Center, Dallas, TX; USA
John B. Buse, MD, PhD
University of North Carolina School of Medicine, Chapel Hill, NC; USA
David Cherney, MD, PhD
University of Toronto, Division of Nephrology, UHN, Toronto General Hospital Research Institute, Toronto, Canada
El SGLT2 se encuentra en los riñones y puede ser hiperactivo en los pacientes con diabetes. En la glucosuria inducida por el SGLT2, el aclaramiento de la creatinina y la excreción fraccionaria de glucosa son mayores en los pacientes con diabetes que presentan sobrepeso u obesidad1. Además, el índice de masa corporal (IMC) afecta a la absorción de glúcidos de hombres y mujeres, así como a la oxidación lipídica durante el ayuno y las comidas2,3. El uso de los inhibidores del SGLT2 aumenta la producción endógena de glucosa, disminuye la asimilación de la glucosa en los tejidos y estimula la lipólisis y la cetogénesis3.
Esta glucosuria inducida por el SGLT2 provoca un cambio en el metabolismo oxidativo, que pasa de los glúcidos a los lípidos. El déficit resultante de glúcidos es más acentuado en las personas delgadas que en las obesas. La menor proporción de insulina/glucagón y el mayor aporte de ácidos grasos libres estimulan la cetogénesis hepática. Este cambio metabólico aumenta el riesgo de cetoacidosis si existe un déficit de insulina o de glúcidos.
Los estudios DEPICT fueron dos ensayos clínicos con un diseño casi idéntico, pero con distintas características geográficas. Se concibieron para verificar la eficacia y la seguridad de dapagliflozina en adición a insulina en diabetes tipo 1. Se consideraron aptos para participar los pacientes con una HbA1c de 7.7 % a 11%. Los pacientes fueron aleatorizados en proporción 1:1:1 para recibir dapagliflozina en dosis de 5 mg + insulina o 10 mg + insulina, o bien placebo + insulina. El tratamiento se prolongó durante 52 semanas tras un período de tamizaje ≤28 días y un período de preinclusión de 8 semanas.
Los dos grupos de dapagliflozina de ambos ensayos presentaron disminución de HbA1c en las semanas 24 y 52 en comparación con el grupo que recibió placebo. Con respecto a este último, se observó asimismo una disminución de la dosis de insulina en los dos grupos de dapagliflozina del estudio DEPICT-2, que se mantuvo durante 24 semanas. No obstante, las reducciones de la dosis fueron más relevantes en el estudio DEPICT-1, con reducciones del 7.7 % en el grupo de dapagliflozina 5 mg y del 12.2 % en el de dapagliflozina 10 mg, en contraste con el 1.2% observado en el grupo del placebo.
Tanto en el estudio DEPICT-1 como en DEPICT-2 se hubo una reducción estadísticamente significativa del peso corporal en ambos grupos de dapagliflozina durante la semana 24 (DEPICT-1 y 2) y la semana 52 (DEPICT-1), con respecto a placebo. La proporción de pacientes que tubo de una reducción de la HbA1c ≥0.5 % sin sufrir episodios de hipoglucemia severa fue mayor en los grupos de dapagliflozina de 5 y 10 mg que en el grupo de placebo a las 24 semanas en el estudio DEPICT-2 (39.5 %, 41.6 % y 20.1 %, respectivamente). En el estudio DEPICT-1 se observaron reducciones de HbA1c aún mayores sin episodios de hipoglucemia severa a las 24 y 52 semanas (24 semanas: 50 %, 51 % y 25 % con las dosis de 5 y 10 mg y con placebo; 52 semanas: 40.2 %, 42.1 % y 23.7 % con 5 y 10 mg y con placebo). Los criterios de valoración del sistema de monitorización continua de la glucosa (CGM) en la semana 24 mostraron mejoras en las concentraciones medias de glucosa intersticial durante 24 h en ambos grupos de dapagliflozina, en contraste con placebo, en los dos estudios DEPICT.
Los eventos adversos más frecuentes estuvieron relacionados con infecciones genitales y urinarias que tuvieron lugar con mayor frecuencia en los dos grupos de dapagliflozina. La cetoacidosis diabética también fue más prevalente en los tratados con el inhibidor que en el grupo de placebo, en ambos ensayos.
Los estudios DEPICT demuestran la buena tolerabilidad del tratamiento con dapagliflozina en la diabetes tipo 1 a lo largo de 52 semanas, acompañada de mejoras del control glucémico y del peso, reducciones de la dosis de insulina y de la variabilidad glucémica y sin aumento de hipoglucemia, si bien con más episodios de cetoacidosis.
El estudio EASE-1 de fase II fue un pequeño ensayo aleatorizado, con doble ciego , controlado con placebo, de 4 semanas de duración realizado en dos centros europeos4. Su objetivo fue investigar la farmacodinámica, la eficacia y la seguridad de empagliflozina como complemento a la insulina en pacientes con diabetes tipo 14. Se administraron tres dosis diarias distintas de la misma: 2.5, 10 y 25 mg. En el estudio de 28 días de duración, empagliflozina, usada como complemento de la insulina, aumentó eficazmente la excreción urinaria de glucosa, mejoró la HbA1c y redujo el peso con dosis más bajas de insulina en comparación con el placebo4.
El ensayo EASE-2 fue un ensayo de 52 semanas que comparó empagliflozina en dosis de 10 y 25 mg con placebo, mientras que EASE-3 tuvo una duración de 26 semanas a lo largo de las cuales se compararon dosis de 2.5, 10 y 25 mg de empagliflozina con el placebo. Para poder participar en cualquiera de ellos, se debía padecer la diabetes tipo 1 desde al menos 12 meses antes (péptido C <0,7 ng/ml) y recibir antes del tamizaje varias inyecciones al día (≥12 meses) o infusión subcutánea continua de insulina (ISCI) (≥5 meses). El intervalo de HbA1c se fijó en ≥7.5 % a ≤10%. El criterio principal de valoración consistió en el cambio de la HbA1c desde el inicio, con tasas de hipoglucemia sintomática confirmada, además de otros aspectos valorados como criterios secundarios (peso, dosis diaria total de insulina y variación de la presión arterial).
Las tres dosis estudiadas de empagliflozina propiciaron reducciones de la HbA1c y adelgazamiento sin que aumentaran los episodios de hipoglucemia sintomática ni severa en contraste con placebo. En los grupos que recibieron 10 y 25 mg de empagliflozina se confirmaron tasas más altas de cetoacidosis. Los resultados no se han publicado y se presentarán en la EASD de octubre de 2018.
La sotagliflozina es un inhibidor doble del SGLT1 y del SGLT2. A modo de resumen, el SGLT1 radica en el intestino y es la principal molécula de transporte implicada en la absorción de la glucosa y de la galactosa. En el riñón desempeña un papel secundario en la absorción de glucosa. Cuando el SGLT2 se bloquea en el órgano renal, la excreción urinaria de glucosa aumenta5,6. El uso de un inhibidor del SGLT1 y uno del SGLT2 retrasa las concentraciones de glucosa postprandial en comparación con los inhibidores del SGLT2 o la ausencia de tratamiento5,6.
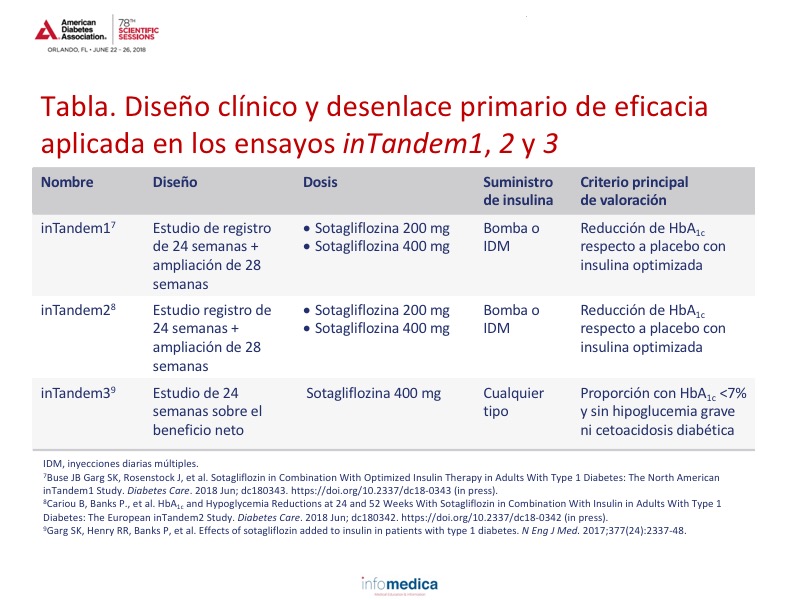
La sotagliflozina se estudió en tres ensayos clínicos en tándem, inTandem 1, 2 y 3. Consulte en la tabla el diseño del estudio y el criterio principal de valoración de eficacia de cada uno.
En un análisis agrupado de la sotagliflozina en inTandem 1 y 2, tanto el grupo de 200 mg como el de 400 mg vieron reducida estadísticamente la HbA1c respecto al inicio y el peso corporal absoluto en comparación con placebo a las 24 y 52 semanas10,11. La sotagliflozina demostró una eficacia estadísticamente significativa a las 52 semanas al reducir las dosis total (200 y 400 mg), basal (200 y 400 mg) y en bolo de la insulina (esta última solo con la dosis de 400 mg) al revisar los datos agrupados de inTandem 1 y 2 y compararlos con el placebo10. Asimismo, se analizó un subconjunto de datos procedentes de pacientes de inTandem 1 y 2 sometidos a MCG para determinar el tiempo transcurrido dentro del intervalo glucémico en los grupos de sotagliflozina con respecto a placebo. A las 24 semanas, la sotagliflozina 200 mg aumentó el tiempo transcurrido en el intervalo glucémico, que pasó de 12 h y 32 min. al inicio a 13 h. y 52 min.12 Por su parte, el grupo de 400 mg lo aumentó de 12 h. y 10 min. al inicio a 15 h. y 25 min.12 Hubo más casos confirmados de cetoacidosis diabética en ambos grupos de tratamiento activo que con placebo10,11. Los casos verificados de hipoglucemia fueron menos frecuentes con sotagliflozina.
En el estudio inTandem 3, el beneficio clínico neto a las 24 semanas (proporción de pacientes con HbA1c <7%, sin hipoglucemia severa y sin cetoacidosis) fue estadísticamente más alto en el grupo de la sotagliflozina que en el de placebo (28.6 % y 15.2 %, respectivamente) así como la reducción de la HbA1c desde el inicio9. Además, en inTandem 3, más pacientes lograron una HbA1c <7 % y un balance beneficio-riesgo más favorable en relación con ello tomando la sotagliflozina que la insulina sola. Hubo más casos confirmados de cetoacidosis entre los tratados con la sotagliflozina que con placebo13. En InTandem3, también fueron menos frecuentes los casos verificados de hipoglucemia en los grupos tratados con la misma.
Existen pocos tratamientos cuyo objetivo sea la protección cardiorrenal del paciente con diabetes tipo 1. Se trata, pues, de una necesidad desatendida ya que muchos de estos pacientes presentan tasas más altas de ECV, ICC y ND. Actualmente, no hay indicios que respalden el uso de nuevos antidiabéticos para la protección órgano blancoen diabetes tipo 2.
La diabetes causa hipertensión glomerular y su incidencia se puede reducir con el uso de inhibidores del SGLT214. Los estudios preliminares en animales han demostrado un efecto sobre la vasoconstricción de la arteriola aferente con el iSGLT2, que probablemente resulta afectada por la natriuresis15. Cuando los pacientes con diabetes tipo 2 fueron tratados con la empagliflozina, se observó menos flujo sanguíneo y más resistencia vascular en el órgano renal, lo cual concuerda con la vasoconstricción de la arteriola aferente observada en los animales14. La hipoxia renal es también motivo de preocupación en el paciente con diabetes. En un estudio en animales que analizó el oxígeno de la corteza renal, los animales con diabetes tipo 1 tenían niveles más bajos de oxígeno que los testigos sanos y que los tratados con floricina16.
Se ha demostrado la existencia de biomarcadores inflamatorios en los pacientes con diabetes tipo 1 y se ha observado la disminución de los mismos con el uso de iSGLT2. Sin embargo, ningún estudio ha revisado hasta la fecha los marcadores inflamatorios en el marco de dicha enfermedad17.
Existe toda una serie de beneficios coincidentes según los ensayos en seres humanos o en animales, parecen estar presentes tanto en la diabetes tipo 1 como tipo 2. Estos son:
- ↓Hiperglucemia, hipoglucemia de bajo riesgo
- ↓Peso corporal
- ↓Necesidades de insulina
- ↓Presión arterial
- Hemoconcentración
- ↓Hiperfiltración renal
- ↓Ácido úrico en plasma.
Mensajes clave
- La glucosuria inducida por los SGLT2 provoca un cambio en el metabolismo oxidativo, que pasa de los glúcidos a los lípidos.
- Existe un riesgo adicional de cetoacidosis diabética en caso de déficit de insulina o de glúcidos.
- La dapagliflozina ha sido el primer inhibidor selectivo del SGLT2 complementario a la insulina en diabetes tipo 1 que ha demostrado reducciones de HbA1c, de la dosis diaria total de insulina y del peso durante 52 semanas.
- Los tratamientos complementarios ala insulina siguen siendo una necesidad desatendida en la diabetes tipo 1.
- Existe un mayor riesgo de cetoacidosis grave cuando se usan los inhibidores del SGLT.
- La sotagliflozina es un doble inhibidor del SGLT1 y del SGLT2 que simultáneamente aumenta la excreción urinaria de glucosa y disminuye la absorción intestinal de este monosacárido.
- La combinación de la sotagliflozina con la insulina en diabéticos tipo 1 duplicó la proporción de pacientes que lograron una HbA1c inferior al 7% sin hipoglucemia severa, pero con más episodios de cetoacidosis que con la insulina sola en el plazo de 24 y 52 semanas.
- Los adultos con diabetes tipo 1 toleraron bien la sotagliflozina combinada con insulina.
- Se necesitan con urgencia ensayos de resultados cardiorrenales en diabetes tipo 1.
REFERENCIAS
Declaraciones de los ponentes:
Ele Ferrannini: el ponente declara haber sido miembro de la junta, miembro de la comisión asesora y consultor de Boehringer-Ingelheim/Eli Lilly, Sanofi. Ha recibido un informe de investigación de Boehringer-Ingelheim, Eli Lilly y Astra Zeneca, y ha estado en las oficinas de los portavoces de Astra Zeneca, Takeda, Novo Nordisk, Sanofi, Tanabe/Mitsubishi y Boehringer Ingelheim.
Paresh Dandona: no hay declaraciones por parte de este ponente.
Juilo Rosenstock: el ponente declara haber recibido apoyo en sus investigaciones por parte de Merck, Pfizer, Sanofi, Novo Nordisk, Bristol-Myers Squibb, Eli Lilly, GlaxoSmithKline, Astra Zeneca, Lexicon, Janssen, Intarcia, Genentech y Boehringer Ingelheim. También ha participado en comisiones asesoras o ha percibido honorarios por asesoramiento de Novo Nordisk, Sanofi, Eli Lilly, Intarcia, Janssen y Boehringer Ingelheim.
John B. Buse: el ponente declara haber recibido apoyo en sus investigaciones por parte de Astra Zeneca, Boehringer Ingelheim, Johnson & Johnson, Lexicon, Novo Nordisk, Sanofi, Theracos y vTv Therapeutics. Ha sido asesor de Adocia, Astra Zeneca, Dexcom, Elcelyx Therapeutics, Eli Lilly, Intarcia Therapeutics, Lexicon, Metavention, NovaTarg, Novo Nordisk, Sanofi, Senseonics, y vTv Therapeutics. El ponente también posee opciones sobre acciones de Mellitus Health y PhaseBio Pharmaceuticals.
David Cherney: el ponente declara haber recibido asesoramiento y honorarios de Boehringer Ingelheim, Lilly, Janssen, Merck, AstraZeneca, Mitsubishi-Tanabe y Sanofi. Además, ha participado en los siguientes ensayos: CREDENCE, TRANSLATE, BETWEEN, DIAMOND, DAPA-CKD, SCORED, EMPA-CKD, INDORSE y ERADICATE-HF.
Escrito por: Debbie Anderson, PhD
Revisado por: Marco Gallo, MD